Collagène
Le collagène est une glycoprotéine fibreuse dont le rôle peut être comparé à une armature. Il s'agit de la protéine la plus abondante de l'organisme et représente 1/4 de l'ensemble des protéines de l'organisme.
Recherche sur Google Images :
Source image : fr.wikivisual.com Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Définitions :
- protéine constituant la substance intercellulaire du tissu conjonctif (source : dietetique)
- Molécule complexe donnant à la peau sa forme et son élasticité. (source : lasermd-strasbourg)
Le collagène est une
Au contraire de l'élastine présente aussi dans les tissus conjonctifs, le collagène est inextensible et résiste bien à la traction. Il est constitué de différents types selon leur localisation. Il est surtout indispensable aux processus de cicatrisation. Après certaines transformations, on peut en faire de la colle.
Les biochimistes connaissent actuellement plus de 100 000 protéines. Ces molécules interviennent dans de nombreux processus. Certaines sont au cœur de l'immunologie. D'autres ont une activité enzymatique indispensable au bon fonctionnement de la machinerie cellulaire. D'autres toujours forment les récepteurs membranaires par lesquels les cellules interagissent avec le milieu environnant. Quelques-unes, enfin, participent à la structuration des organismes. C'est le cas du collagène, une protéine principale des tissus conjonctifs des Animaux.
Une molécule particulièrement abondante
Les protéines se séparent en deux catégories. Les protéines fonctionnelles interviennent dans des processus biochimiques (enzymologie, immunologie, récepteurs membranaires, etc. ). Les protéines structurales façonnent les organismes en contribuant à leur structure. Parmi celles-ci, le collagène est spécifiquement représentatif. Cette protéine fibreuse est de loin la plus abondante chez l'ensemble des Mammifères : elle représente un quart de leur protéines, soit environs 5% de leur poids.
Il existe différents types de collagène
Le collagène est une protéine composée de trois chaînes polypeptidiques associées. Ces trois chaînes pouvant se combiner de différentes manières, on devrait en toute rigueur parler des collagènes, et non du collagène. Chaque type de collagène possède une structure propre et se retrouve dans des organes spécifiques. A titre d'exemple, le collagène de type I intervient dans la formation de la peau, des tendons, des os et de la cornée, alors que le type III se retrouve au niveau du dispositif cardiovasculaire.
| Type | Description | Gène (s) |
| I | 90% du collagène d'un vertébré. Il forme la trame de l'os (à comparer aux armatures du béton armé), et d'une façon plus générale des tissus conjonctifs banals. On le rencontre dans les os, la peau, les tendons, la cornée et les organes internes. | COL1A1, COL1A2 |
| II | Forme de fines fibrilles dans la substance principale du cartilage hyalin (avec les collagènes IX, X et XI) dans le nucléus pulposus du corps vertébral et dans le corps vitré de l'œil. | COL2A1 |
| III | Il est constitutif des fibres de réticuline trouvées en proportion importante dans les tissus hématopoïétiques. À l'état de collagène, on le trouve surtout dans le muscle squelettique et dans la paroi des vaisseaux sanguins. Les fibres sont argyrophiles et PAS positives | COL3A1 |
| IV | Spécifique des lames basales, il forme un réseau. Il n'est pas strié en microscopie électronique | COL4A1, COL4A2, COL4A3, COL4A4, COL4A5, COL4A6 |
| V | Localisé dans les tissus conjonctifs, il s'associe au type I | COL5A1, COL5A2, COL5A3 |
| VI | Localisé dans le tissu conjonctif, il s'associe au type I | COL6A1, COL6A2, COL6A3 |
| VII | Constituant de la lame basale. Il forme des fibrilles donnant la possibilité l'accrochage de la lame basale au tissu conjonctif sous-jacent. | COL7A1 |
| VIII | Localisé dans les cellules endothéliales. | COL8A1, COL8A2 |
| IX | Localisé dans le cartilage, s'associe au collagène de type II | COL9A1, COL9A2, COL9A3 |
| X | Localisé dans le cartilage hypertrophié et minéralisé. | COL10A1 |
| XI | Localisé dans le cartilage. | COL11A1, COL11A2 |
| XII | Interagit avec les types I et III. | COL12A1 |
| XIII | - | COL13A1 |
| XIV | - | COL14A1 |
| XV | Disséminés; près de la lame basale des muscles. | COL15A1 |
| XVI | - | COL16A1 |
| XVII | Également nommé BPAG2. C'est une protéine transmembranaire qui se fixe à la lame basale d'hémidesmosomes, au niveau de l'épiderme surtout. Les fibres de collagène de type XVII sont disposées parallèlement aux intégrines α6β4. Ces deux protéines permettent par conséquent de renforcer l'ancrage de la lame basale. | COL17A1 |
| XVIII | - | COL18A1 |
| XIX | - | COL19A1 |
| XX | - | COL20A1 |
| XXI | - | COL21A1 |
| XXII | - | COL22A1 |
| XXIII | - | COL23A1 |
| XXIV | - | COL24A1 |
| XXV | - | COL25A1 |
| XXVII | - | COL27A1 |
| XXVIII | - | COL28A1 |
Quand le collagène est partiellement hydrolysé, les trois brins de tropocollagène se dissocient. Ils forment ainsi la gélatine, un produit beaucoup utilisé dans l'agroalimentaire. La gélatine a aussi été utilisée dans l'industrie pharmaceutique, en cosmétique et en photographie. Le collagène et la gélatine sont reconnus comme des protéines de piètre qualité nutritionnelle car ils ne possèdent pas l'ensemble des acides aminés en proportions correctes.
Le terme collagène veut dire "producteur de colle" (le nom vient en effet d'un mot grec, kolla signifiant colle). Les propriétés du collagène ont été utilisées par les Egyptiens il y a 4 000 ans. Les Amérindiens l'utilisaient il y a 1 500 ans. La plus ancienne colle connue est faite à partir de collagène, et date de 8 000 ans. Aujourd'hui on l'utilise dans : les produits de beautés ou comme additif dans les poulets
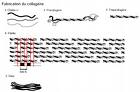
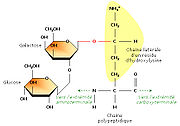
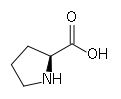
Le tropocollagène est l'unité principale du collagène, et correspond à une molécule asymétrique de 280nm de long et de 1, 5nm de diamètre. C'est une glycoprotéine constituée par l'enroulement en hélice de 3 chaînes polypeptidiques α, porteuses de glucide (glucose, galactose). Les acides aminées sont constitués pour un tiers de glycine, pour un tiers de proline, d'hydroxylysine et de 4-hydroxyproline. Il existe plusieurs types moléculaires de chaînes α. Ces chaînes sont constituées par des séquences répétitives de trois acides aminés, dont le premier, la glycine est répété tout au long de la molécule. Les glucides sont fixés sur l'hydroxylysine. L'enroulement des 3 chaînes α, aboutit à la constitution de la molécule de tropocollagène, dont la cohésion est assurée par des liaisons hydrogènes entre la glycine et l'hydroxyproline.
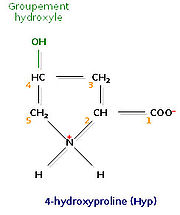
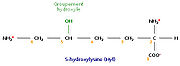
L'analyse de la composition d'une molécule de tropocollagène révèle de nombreuses singularités. Les biochimistes ont montré que le tiers des résidus sont des résidus de glycine, ce qui est caractéristique des protéines de structure. Autre fait singulier, plus de 10% des résidus sont des prolines. Enfin, on observe la présence de deux acides aminés peu courants, la 4-hydroxyproline (Hyp) et la 5-hydroxylysine (Hyl).
Les biochimistes ont aussi constaté que l'ordre d'enchaînement des acides aminés qui composent le tropocollagène présente aussi des anomalies. En d'autres termes, la séquence d'acides aminés ne correspond pas à ce qu'on rencontre généralement. On observe en effet que les glycines se retrouvent régulièrement l'ensemble des trois résidus. La structure de la séquence des acides aminés du collagène est par conséquent (Gly – Xn – Yn) n. De plus, la séquence comporte assez fréquemment des triplets Gly – Pro – Hyp. Toutes ces propriétés sont singulières étant donné qu'elles ne se retrouvent pas chez la majorité des protéines.
Hydroxylation et glycosylation
Les deux acides aminés hydroxylés que sont l'hydroxyproline (Hyp) et l'hydroxylysine (Hyl) soulèvent tout naturellement une question : l'hydroxylation intervient-elle avant ou après la synthèse peptidique ? Pour y répondre, les biochimistes ont recherché un aminoacyl-ARNt codant l'un ou l'autre de ces acides aminés. N'en ayant pas trouvé, ils ont conclu que l'hydroxylation de certains résidus de proline et de lysine est un processus post-traductionnel. En réalité, deux enzymes catalysent cette réaction. Ce sont respectivement la prolylhydroxylase et la lysylhydroxylase. Toutes deux ne peuvent agir qu'en présence d'ascorbate (ou vitamine C), ce dernier empêchant le fer ferreux (Fe2+) contenu dans leur centre actif d'être inactivé sous forme de fer ferrique (Fe3+). Une carence sévère en ascorbate est à l'origine du scorbut, une maladie due à un défaut de fabrication du collagène, lequel se traduit par une fragilisation des tissus. Les marins, lors des grands voyages, étaient fréquemment victimes du scorbut, faute de pouvoir consommer des fruits et des légumes.
Les résidus de proline susceptibles d'être hydroxylés sont obligatoirement localisés à gauche d'un résidu de glycine. Les autres résidus ne peuvent être hydroxylés. Il en va de même pour les résidus de lysine.
(extrémité aminoterminale) NH3+ – … – Pro – Gly – … – COO– (extrémité carboxyterminale)
(extrémité aminoterminale) NH3+ – … – Lys – Gly – … – COO– (extrémité carboxyterminale)
Très rarement, certains résidus de proline sont hydroxylés au niveau du carbone 3 et non du carbone 4. L'enzyme responsable de cette hydroxylation n'est pas la prolylhydroxylase, et l'hydroxylation ne respecte pas les règles que nous venons de définir.
En étudiant la structure du tropocollagène, les biochimistes ont aussi montré que certains résidus d'hydroxylysine possédaient des résidus sucrés (2-glucosyl-galactose). Le fait que le collagène soit lié de façon covalente à de courts glucides en fait une
La conformation spatiale du tropocollagène est celle d'un cylindre hélicoïdal à trois bandes de 300 nm de long et de 1, 5 nm de diamètre. Cette protéine ne présente par conséquent pas la forme globulaire classique des protéines fonctionnelles. C'est une tige longue et fine. Chaque bande du cylindre est une chaîne polypeptidique elle-même repliée en hélice ; la totalité des trois chaînes forme une tresse spécifiquement résistante. En effet, il faut une charge de 10 kg pour casser une fibre de collagène d'un diamètre d'un millimètre.
Nous avons dit que chaque chaîne polypeptidique est repliée en hélice. Cette structure secondaire est sans rapport avec l'hélice alpha. C'est un autre type de structure secondaire. Il s'agit ici d'une hélice dont l'enroulement résulte de la répulsion des cycles pyrrolidones des nombreux résidus de proline. Les cycles pyrrolidones se repoussent mutuellement à cause de leur fort encombrement stérique. L'hélice obtenue est moins tassée que l'hélice alpha (0, 15 nm par résidu) puisque on a pu mesurer une distance de 0, 29 nm par résidu. Enfin, contrairement aux hélices alpha, on n'observe pas de ponts hydrogène intracaténaires. On trouve néanmoins des ponts hydrogène intercaténaires. Les ponts hydrogène mettent en jeu les résidus de glycine (donneurs de protons) et les groupements carboxyle (accepteurs de protons). Quand les chaînes se croisent, il est indispensable de diminuer l'encombrement stérique. Ceci est rendu envisageable par la présence de résidus de glycine, l'acide aminé le moins encombré. Les autres chaînes latérales sont rejetées hors de la structure en triple hélice.
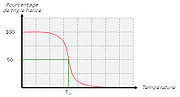
Quand on chauffe une solution de tropocollagène, on observe un effondrement brusque de la structure en hélice à une température donnée, notée Tm (température de fusion ou melting temperature dans la terminologie anglo-saxone). Cette expérience montre que les ponts hydrogène assurent le maintien de la structure en triple hélice. Ces interactions faibles (c'est-à-dire non covalentes) sont suffisamment nombreuses pour modifier sensiblement le comportement de la molécule. On ne doit pas s'en étonner : la fibroïne, protéine structurale de la soie fabriquée par les araignées, doit son élasticité et sa résistance à l'existence de très nombreux ponts hydrogène qui forment des interactions coopératives. De la même façon, les propriétés singulières de l'eau, surtout son point d'ébullition "anormalement" élevé, sont la conséquence directe de l'existence de nombreux ponts hydrogène. La mesure de la température de fusion Tm est rendue envisageable par le fait qu'elle marque un changement de viscosité de la solution et une modification de la dispersion optique rotatoire (DOR).
Les hydroxylations observées sur le collagène offrent un gain de stabilité. Leur nombre fluctue par conséquent selon le type de tissu et de la température corporelle. Certains tissus présentent un plus fort taux d'hydroxylation que d'autres. C'est surtout le cas du placenta et de la peau.
| Pro et Hyp (‰) | Température de fusion (°C) | Température corporelle (°C) | |
| Peau de veau | 232 | 39 | 37 |
| Peau de requin | 191 | 29 | 24 à 28 |
| Cabillau | 155 | 16 | 10 à 14 |
Le collagène n'a pas sa place dans les cellules elle-mêmes ; c'est pourquoi sa synthèse s'effectue à partir d'un précurseur présent dans les cellules, le procollagène. Ce dernier est constitué de brins bien plus longs, rallongés par des structures polypeptidiques supplémentaires, de 15 kDa du côté aminoterminal et de 30 kDa du côté carboxyterminal. Ces structures sont banales et portent le nom de propeptides. A l'extrémité carboxy-terminale existent des ponts disulfure intercaténaires à rôle stabilisateur. Les ponts sont intracaténaires à l'extrémité aminoterminale.
Le procollagène est un assemblage de 3 protéines de collagène alpha (alpha1 - alpha1 - alpha2) en une hélice droite. Les fibres de procollagène s'assemblent en une structure nommée fibrille de collagène. L'assemblage de plusieurs fibrilles de collagène forme la fibre de collagène. Les fibrilles présentent une alternance de phase sombre et claire due a l'espacement et au décalage des fibres de procollagène.
Dans le réticulum endoplasmique
Les trois chaînes de procollagène sont synthétisées transférées dans le lumen du réticulum endoplasmique (on parle de translocation). La région contenant la triple hélice est flanquée d'un peptide signal et de deux propeptides aminoterminal et carboxyterminal. Ceux-ci aident à la maturation de la protéine.
Modifications post-traductionnelles
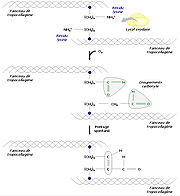
Une fois dans le réticulum endoplasmique, le peptide signal est clivé. Par la suite intervient l'hydroxylation de plusieurs prolines et lysines. Le propeptide carboxyterminal est modifié par N-glycosylation, alors que certaines hydroxylysines sont O-glycosylées. Les différentes modifications post-traductionnelles et la formation de ponts disulfure entre les propeptides carboxyterminaux de trois chaînes permettent ensuite leur alignement. La triple hélice s'enroule alors comme une fermeture éclair, en direction de l'extrémité aminoterminale.
Enfin, dans l'appareil de Golgi, la triple hélice est flanquée de régions non hélicales. Le propeptide est alors libéré dans le milieu extracellulaire par exocytose. Une enzyme, la procollagène peptidase, clive alors les deux propeptides, donnant la possibilité la formation de tropocollagène mature. En tout dernier lieu, les faisceaux de tropocollagène s'assemblent à proximité de la surface cellulaire, s'interconnectent et forment des fibres de collagène matures.
Formation des fibres de collagène
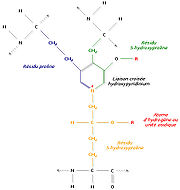
Pour former des fibres de collagène matures, les faisceaux de tropocollagène doivent s'assembler. Divers processus biochimiques y amènent. A titre d'exemple, une enzyme, la lysyl oxydase, permet la substitution d'un groupement carbonyle au groupement amine d'un résidu lysine, ce qui est à l'origine de pontages spontanés en plusieurs faisceaux de tropocollagène. On procède ainsi à une réticulation des molécules par condensation aldolique.
Un autre mécanisme consiste à relier trois régions polypeptidiques par une liaison croisée hydroxypyridinium (ou hydroxypyridinoline). Il se forme alors une structure en échelle qui présente une périodicité de 680 Å, visible en microscopie électronique. Les zones inoccupées entre les différentes molécules de tropocollagène sont remplies avec un hydroxyphosphate de calcium, l'hydroxyapatite, de formule Ca10 (PO4) 6 (OH) 2. La succession régulière de tropocollagène et d'hydroxyapatite est à l'origine de la striation visible en microscopie électronique.
La dégradation du collagène est complexe et nécessite des enzymes spécifiques, les collagénases (de la famille des métalloprotéinases matricielles). A titre d'exemple, les collagénases d'origine bactérienne (par exemple Clostridium histoliticum, dont le nom d'espèce veut dire "destructeur de tissus") sont capables de cliver chaque chaîne de collagène en plus de deux cents points (parmi lesquels X – Gly – Pro – Y). D'autres organismes tels que les amphibiens possèdent des collagénases particulièrement spécifiques, capables d'effectuer une seule coupure à un site défini.
Outre le scorbut, dont nous avons déjà parlé, de nombreuses maladies sont liées à des défauts de synthèse du collagène, parmi lesquelles la maladie des os de verre. On se référera à l'article Maladies héréditaires du collagène.
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 05/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.




 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité