Hsp60
Les Heat shock proteins sont le plus souvent responsables de la prévention des dommages à des protéines en réponse à des niveaux élevés de température.
Les Heat shock proteins sont le plus souvent responsables de la prévention des dommages à des protéines en réponse à des niveaux élevés de température. Les protéines de choc thermique sont classées en six grandes familles selon leur masse moléculaire : petite Hsps, Hsp40, Hsp60, Hsp70, Hsp90, et Hsp110.
Découverte
L'HSP60 de mammifères a été signalée pour la première fois comme une protéine mitochondriale P1. Elle a ensuite été clonée et séquencée par Radhey Gupta et collaborateurs[1]. La séquence d'acides aminés a montré une forte homologie avec GroEL. On a en premier lieu cru que HSP60 fonctionnait uniquement dans les mitochondries et qu'il n'y avait pas d'équivalent en protéines se trouvant dans le cytoplasme. Les découvertes récentes ont discrédité cette première approche et ont suggéré qu'il existe une différence notable entre HSP60 des mitochondries et Hsp60 du cytoplasme[2]. Une structure identique existe dans le chloroplaste de certaines plantes.
Structure
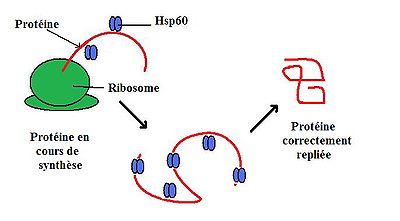
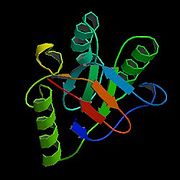
Dans les conditions physiologiques normales, HSP60 fait 60 kiloDalton et se compose d'oligomères et de monomères qui forment un complexe organisé en deux anneaux empilés[3]. Cette double structure en anneau forme une grande cavité centrale dans laquelle s'est déroulée la protéine et où elle est liée par des interactions hydrophobes[4]. Cette structure est le plus souvent en équilibre avec chacun de ses composants individuels : les monomères, heptamers, et tetradeceamers[5]. Des études ont commencé à suggérer que, en plus de son emplacement typique dans les mitochondries, HSP60 peut aussi être trouvé dans le cytoplasme sous conditions physiologiques normales[2].
Notes
- ↑ Gupta, RS. Evolution of chaperonin families (HSP60, HSP10, and TCP-1) of proteins and the origin of eukaryotic cells. Molecular Microbiology 15, 1-11, 1995.
- Itoh, H; Komatsuda, A; Ohtani, H; Wakui, H; Imai, H; Sawada, K, Otaka, M; Ogura M; Suzuki, A; Hamada, F. Mammalian HSP60 is quickly sorted into the mitochondria under conditions of dehydration. Eur. J. Biochem. 269, 5931-5938, 2002.
- ↑ Cheng, MY; Hartl, FU; Horwich, AL. The mitochondrial chaperonin HSP60 is required for its own assembly. Nature 348 : 455- 458; 1990.
- ↑ Fenton, WA. Residues in chaperonin GroEL required for polypeptide binding and release. Nature 371, 614-619; 1994.
- ↑ Habich, C; Burkart, V. Heat shock protein 60 : regulatory role on innate immune cells. Cell Mol. Life Sci. 64, 742-751, 2007.
Recherche sur Google Images : |
|
"Solid ribbon model of Hsp60" L'image ci-contre est extraite du site en.wikipedia.org Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (250 x 250 - 14 ko - jpg)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 05/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité