Aquaporine
Les aquaporines sont une classe de protéines membranaires qui forment des «pores» perméables aux molécules d'eau dans les membranes biologiques.
Les aquaporines (AQP) sont une classe de protéines membranaires qui forment des «pores» perméables aux molécules d'eau dans les membranes biologiques.
Les aquaporines permettent le passage de l'eau de part et d'autre de la membrane tout en empêchant les ions de pénétrer dans la cellule.
Aujourd'hui, à peu près 500 aquaporines ont été découvertes autant dans le règne végétal qu'animal, dont 12 chez l'Homme.
Découverte
Les aquaporines n'ont été que récemment découvertes ; par Peter Agre en 1992 en injectant l'ARNm de la protéine dans un œuf de xénope tandis qu'il étudiait les globules rouges et leurs parois. Il a en 2003 reçu le Prix Nobel de chimie pour ses travaux.
On supposait l'existence d'une structure de ce type car la pénétration osmotique de l'eau au travers des membranes lipidiques ne pouvait expliquer l'importance des échanges et flux observés au niveau cellulaire, des organes (reins par exemple capable de traiter l'équivalent de plusieurs centaines de litre d'eau par jour) et organismes.
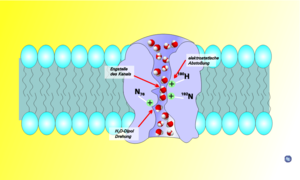
Ce sont des protéines de 250 à 300 acides aminés et 25 à 35 kD (kilo Dalton). Elles sont constituées de 6 hélices alpha s'insérant dans la bicouche lipidique constituante de la membrane. Ces 6 hélices sont reliées par des boucles d'acides aminés dont 3 spécifiquement importantes se trouvent au milieu des boucles B et E : NPA (N pour asparagine, P pour proline et A pour alanine).
C'est face à ce motif NPA que la cassure des ions H+ peut se faire : les deux boucles interagissent pour former une septième hélice créant un étranglement de de 3 Ångströms de diamètre dans le canal qui forme le pore.
Les aquaporines sont des homotétramères indépendants, c'est-à-dire qu'elles sont composées de 4 monomères capables de transporter les molécules d'H2O individuellement. On pourrait les comparer à un sablier qui ferait passer une à une les molécules.
Mécanisme de fonctionnement
L'eau liquide est constituée de molécules d'eau significativement liées les unes aux autres par des liaisons chimiques entre atomes d'oxygène et d'hydrogène («liaison hydrogène»).
Selon les modélisations informatiques, ces molécules quand elles entrent dans l'entonnoir du pore (canal hydrique) constitué par 4 aquaporines, sont progressivement alignées tandis que le pore qui se rétrécit (le pore a une forme de sablier). Les forces électrostatiques faibles résultant de la configuration interne du pore positionnent alors chaque molécule d'eau dans une même position ; atome d'oxygène en premier. Arrivée au centre du canal chaque molécule d'eau est individuellement happée par l'attraction chimique de certains acides aminés qui tapissent l'intérieur du pore. Elle est ensuite retournée sur elle-même (par interaction avec deux asparagines présentes à l'entrée de l'étranglement). Ce retournement brutal de la molécule casse pour un un instant la liaison hydrogène et isole la molécule du flux cohérent de la file des molécules d'eau et la pousse vers la sortie du pore (cette fois les atomes d'hydrogène situés vers la sortie). Seule les molécule d'eau et certains solutés passent ce type de "porte". Les ions hydrogène (ion hydronium en solution aqueuse (quelquefois nommés protons), qui forment la réserve énergétique de la cellule sont eux repoussés[1], quoique plus petit et solubles dans l'eau ; Ces pores sont complètement étanche aux protons, permettant aux cellules de conserver leur potentiel électrochimique.
- Voir une animation décrivant le trajet et retournement des molécules d'eau traversant un pore constitué d'aquaporines (fichier Mpeg assez lourd. ADSL recommandée).
Fonctions
Les aquaporines expliquent la plus ou moins grande perméabilité des membranes cellulaires biologiques à l'eau. Elles permettent aux cellules des organes d'absorber, conserver ou excréter l'eau et jouent un rôle majeur dans le contrôle de l'hydratation des organismes vivants et dans la circulation de l'eau entre différents organes ou différentes parties d'une cellule. Elles autorisent l'eau d'entrer et/ou sortir d'une cellule, sans laisser passer d'autres molécules (toxiques à maintenir hors des cellules, ou au contraire principales aux cellules ainsi qu'à maintenir dans celles-ci).
Leur fonctionnement est contrôlé par des hormones (vasopressine chez les mammifères) et peut être inhibé par certains toxiques (mercure par exemple)
Elles sont principales à l'activité d'organes tel que le rein (dont les cellules comportent 3 sortes d'aquaporines différentes).
Elles sont impliquées dans des fonctions biologiques tels que les pleurs.
Un défaut génétique dans l'expression de ces protéines a été associé avec certaines maladies humaines[2], [3].
Par exemple une mutation de l'AQP2 est responsable au niveau du rein d'une déshydratation sévère. Cette AQP2, si elle est présente en surnombre, est aussi responsable d'œdème (⇒ insuffisance cardiaque).
L'AQP0, quant à elle est responsable de la cataracte si elle est mutée.
Quelques aquaporines
| Protéine | Activité identifiée | Espèces exclues | Inhibition par les sels de mercure | Localisation principale |
|---|---|---|---|---|
| AQP0 | Canal hydrique | Œil | ||
| AQP1 | Canal hydrique (polyols à 3C) | Ions, urée, polyols à 4C | oui (sur Cys189) | Erythrocytes, rein, œil, cerveau (plexus choroïde), cœur, poumon, etc |
| AQP2 | Canal hydrique | Urée | oui | Rein (tube collecteur) |
| AQP3 | Canal hydrique (glycérol, urée) | acides aminés, ions, sucres | oui | Rein, appareil gastro-intestinal, poumon, vessie |
| AQP4 | Canal hydrique | Ions, urée, glycérol | non | Cerveau, œil, rein, poumon, intestin |
| AQP5 | Canal hydrique | Glandes lacrimales et salivaires | ||
| alpha-TIP | Canal hydrique | ions | Vacuoles des graines |
Notes et références
- ↑ de Groot BL, Grubmüller, The dynamics and energetics of water permeation and proton exclusion in aquaporins, Curr. Opin. Struct. Biol. Vol. 15, p. 176 à 83, 2005
- ↑ Agre P, Kozono D, Aquaporin water channels : molecular mechanisms for human diseases, journal = FEBS Lett., Vol 555, pages 72–8, 2003
- ↑ Schrier RW, Aquaporin-related disorders of water homeostasis, Drug News Perspect. Vol. 20, pages 447–53, 2007
Voir aussi
Liens externes
- Animation, montrant le passage de molécules d'eau, contrôlé par une aquaporine.
Recherche sur Google Images : |
|
"aquaporine" L'image ci-contre est extraite du site colvir.net Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (304 x 190 - 13 ko - jpg)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 05/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.



 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité