Myosine
La myosine est une protéine qui joue un rôle essentiel dans les mécanismes de la contraction musculaire. Cette protéine intracytoplasmique se rencontre par conséquent dans les cellules à activité contractile des vertébrés, telles les cellules musculaires.
Recherche sur Google Images :
Source image : snv.jussieu.fr Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Définitions :
- (gr. mus, muscle). Protéine musculaire formant avec l'actine l'actomyosine. (source : nzdl.sadl.uleth)
La myosine est une protéine qui joue un rôle essentiel dans les mécanismes de la contraction musculaire. Cette protéine intracytoplasmique se rencontre par conséquent dans les cellules à activité contractile des vertébrés, telles les cellules musculaires.
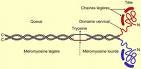
Elle se compose de deux chaînes lourdes (dimère) de 2 000 acides aminés dont les extrémités C-terminales en hélice α sont surenroulées, ce qui confère à la myosine la forme rigide d'un bâtonnet de 180 µm, et dont les têtes N-terminales de 190 acides aminés forment les domaines moteurs. Sont associées à ces deux chaînes lourde deux paires de chaînes légères : une paire de chaînes légères dites principales (ELC), et une paire de chaînes légères dites régulatrices (RLC) qui stabilisent la longue hélice près du domaine N-terminal (tête), dans la région du cou qui forme le ‘bras de levier'.
Les chaînes lourdes de myosine peuvent être coupées par la trypsine en deux parties, la queue nommée aussi méromyosine légère (LMM) et la tête, constituée en partie de la portion globulaire de la molécule. Cette dernière est nommée méromyosine lourde (HMM). La méromyosine lourde peut, à son tour être subdivisée en deux parties, le subfragment 1 (S1) et le subfragment 2 (S2). S1 est une association de trois sous unités de 25, 50 et 20 kDa formant la partie globulaire de la molécule. Elle contient les domaines moteurs qui sont des sous unités de 50 et 20 kDa. Ces domaines moteurs possèdent l'activité ATPase et le site de fixation avec l'actine. La sous unité de 20kDa fixe les chaînes légères.
Il existe différentes isoformes de chaînes lourdes dans le muscle strié squelettique, certaines associées à une vitesse de contraction rapide (MHC-2a, MHC-2d/2x, MHC-2b), d'autres à une vitesse de contraction lente (MHC-1, appelé aussi MHC-1β). Cependant il existe d'autres isoformes de myosine spécifiques de certains muscles (MHC extra-oculaire, MHC mandibulaire) mais également une isoforme spécifique du cœur (MHC Iα). Au cours du développement, deux autres isoformes sont aussi exprimées (MHC embryonnaire et MHC néonatal)
L'expression de ces isoformes de chaîne lourde de myosine, dépend du type de fibre (rapide, lente) mais également de l'espèce. Ainsi chez l'homme l'isoforme la plus rapide, outre dans le muscle extra-oculaire (où l'isoforme MHC extra-oculaire est exprimée), est l'isoforme MHC 2x tandis que chez les rongeurs, c'est l'isoforme MHC-2b. Il existe aussi différentes isoformes de chaînes légères de myosine. En ce qui concerne les chaînes légères principales, 5 isoformes majeures ont été identifiées chez les mammifères. MLC 1 rapide (MLC – 1 f) et MLC – 3 rapide (MLC – 3 f) sont exprimées dans les muscles rapides. MLC – 1 lente α (MLC – 1 S α) et MLC 1 lente β (MLC – 1 S β) aussi nommée MLC 1 lente ventriculaire (MLC-1 S/V) sont exprimées dans les muscles lents mais également respectivement dans les muscles lisses et les ventricules du muscle strié cardiaque. MLC – 1 S α est l'isoforme majoritaire dans les muscles striés squelettiques humains et de lapin, faiblement exprimée chez le rat et est inexistante chez la souris adulte. Au cours du développement, une autre isoforme est exprimée la MLC embryonnaire (MLC 1 emb). Cette isoforme est aussi exprimée dans l'oreillette du muscle strié cardiaque. (?, Le muscle strié cardiaque de l'oreillette, probablement)
La myosine s'associe à une autre protéine, l'actine, au niveau des têtes de chaînes légères. La contraction des fibres musculaires résulte du glissement des myofilaments d'actine sur les myofilaments de myosine. L'énergie étant apportée par l'hydrolyse de l'ATP sous l'action enzymatique de la myosine elle-même.
Il existe plusieurs types de myosine, qui changent par le nombre de "tête" (une ou deux), par la longueur des différentes parties. La myosine de type II est celle qui forme l'appareil contractile du muscle strié squelettique
Le modèle aujourd'hui admis pour le fonctionnement des myosines est celui avancé par le Pr Toshio Yanagida d'un modèle de mouvement brownien biaisé. La myosine est au repos fortement liée au filament d'actine. L'ATP, en se fixant sur la myosine provoque un changement conformationnel, qui détache en partie la myosine du filament. La myosine pourrait alors glisser en suivant la chaîne des monomères d'actine, dans un sens comme dans l'autre, avec un déplacement global orienté (le filament d'actine est polarisé). Le moteur essentiel du déplacement est par conséquent l'agitation thermique.
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 05/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité