Facteur induit par l’hypoxie
Les facteurs induits par l'hypoxie sont des protéines agissant comme dans l'ensemble des tissus et régulés par l'absence d'oxygène.
Les facteurs induits par l'hypoxie (HIFs pour Hypoxia Inducible Factors) sont des protéines agissant comme dans l'ensemble des tissus et régulés par l'absence d'oxygène. D'un point de vue physiologique, l'hypoxie tissulaire est traitée en stimulant la sécrétion de l'hormone érythropoïétine (EPO) qui génère la production de globules rouges, et , donc, augmente l'apport d'oxygène aux tissus cibles. Au niveau moléculaire, ce travail est surtout assuré par HIF-1, soit le complexe le plus actif de la famille des HIFs. Cette protéine a été découverte en 1992 par un chercheur du nom de Gregg Semanza qui étudiait le gène de l'EPO. En réalité, il a découvert une séquence localisée en position 3'non-codante dans le promoteur de l'EPO, qui porte le nom d'hypoxia response element (HRE) et qui fixe la protéine HIF-1 en situation d'hypoxie. Par la suite, la séquence HRE a aussi été située sur plus de 70 autres gènes, tels le vascular endothelial growth factor (VEGF).
Structure
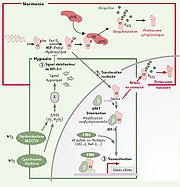
HIF-1 est un hétérodimère obligatoire qui comprend une composante alpha de 826 acides aminés. On la retrouve constituée de 15 exons, sur le chromosome 14 (14q21-q24). De son côté, la composante bêta contient 789 acides aminés et est localisée sur le chromosome 1 (1q21). Ces deux unités font parties de la grande famille des facteurs de transcription bHLH-PAS (basic-helix loop helix / Per-ARNT-SIM). Le domaine HLH de la protéine agit sur la dimérisation des deux sous-unités tandis que la partie basique intervient dans la fixation et la spécificité de la liaison de la protéine sur l'ADN. La composante bêta est aussi nommé ARNT1, pour aryl hydrocarbon receptor nuclear translocator et est exprimée de façon constitutive dans le noyau de la cellule pour la détoxification de celle-ci. Par contre, on retrouve HIF-1α de façon stable, essentiellement en situation d'hypoxie.
Régulation
Très instable en normoxie, la sous-unité alpha subit une hydroxylation, par des prolyl-hydroxylases (PHD), dès sa sortie du noyau, puis est liée par la protéine pVHL (von Hippel Lindau protein), une protéine suppresseure de tumeur, qui induit une activité d'ubiquitination, ce qui mène à la dégradation de cette sous-unité alpha par le protéasome cytoplasmique. Cette étape se produit assez rapidement, puisque HIF-α possède une demie-vie d'uniquement 5 minutes dans le cytoplasme. De plus, la normoxie cellulaire entraîne aussi l'activation de la protéine factor inhibiting HIF-1 (FIH-1) qui agit au niveau du noyau en bloquant la transcription de gènes cibles comme l'EPO. De son côté, la sous-unité bêta est toujours active, sous l'influence du facteur de transcription sp1. En situation d'hypoxie, la sous-unité alpha devient stable, car elle n'est plus hydroxylée par les PHD (son substrat étant l'oxygène), par conséquent elle ne lie plus la protéine pVHL. Elle est alors transportée dans le noyau par translocation nucléaire où elle se liera à la sous-unité bêta ainsi qu'à certains co-facteurs comme le p300/CBP. Le complexe HIF-1 ainsi constitué permettra la transcription des gènes cibles, par exemple en se fixant à la séquence HRE sur le promoteur de l'EPO. Finalement, l'hypoxie agit aussi en bloquant l'activité de FIH-1. Lors d'un retour aux conditions normales d'oxygène, les protéines HIF-α se trouvant dans le noyau subiront aussitôt une ubiquitination et seront dégradées par le protéasome nucléaire.
Bien que l'hypoxie soit le principal activateur de HIF-α, il arrive quelquefois que d'autres inducteurs, tels que l'insuline, les phospholipides, les facteurs de croissance, les cytokines, les Epidermal Growth Factors (EGF) et les Insulin-like Growth Factor-1 (IGF), agissent par des récepteurs couplés à une protéine G en augmentant la transcription de la protéine en situation de normoxie. Ainsi, ce n'est pas forcément l'EPO qui est synthétisé, mais bien d'autres protéines comme le VEGF qui augmente l'angiogénèse, aussi lors du développement embryonnaire. C'est pourquoi un déficit en HIF-1 entraîne infailliblement un important retard de développement et fréquemment, la mort de l'embryon.
Physiopathologie
De récentes recherches ont mis en évidence l'active participation de HIF-1 dans les tumeurs cancéreuses humaines. Plusieurs mécanismes peuvent être à l'origine de cette surexpression de HIF-1, tel que la création d'une région hypoxique intratumorale qui stabilise HIF-1α et induit le complexe HIF-1 ou bien des mutations par gain de fonction qui activent certains facteurs de croissance induisant aussi la transcription de HIF-1α.
La principale maladie qui occasionne des problèmes au niveau de HIF-1 est causée par le syndrome von Hippel Lindau qui se définit par une mutation dans le gène de la protéine pVHL. Les personnes atteintes seront hétérozygotes pour l'allèle muté et des tumeurs apparaîtront au niveau de la rétine, des reins ou du dispositif nerveux central. La protéine pVHL n'étant plus là pour inhiber la surexpression de HIF-1α, les tumeurs présentent alors une grande vascularisation et une forte tendance à créer des métastases.
On sait que dans un cancer la forte prolifération des cellules demande énormément d'énergie, et par conséquent d'oxygène, pour progresser. Quand il y a diminution de l'oxygène intratumorale, la protéine HIF-1 aide alors à la création de nouveaux vaisseaux sanguins pour l'apport d'oxygène. Donc, il a été démontré que l'absence de la protéine HIF-1 entraîne une diminution de la prolifération cellulaire, du chimiotactisme, du réarrangement cellulaire et de l'angiogénèse au niveau de la tumeur. Il y a peu de temps, une étude a été publiée pour prouver que les anti-oxydants avaient envisageablement un rôle à jouer dans le traitement contre les cancers. En réalité, les anti-oxydants neutralisent les radicaux libres qui seraient essentiels à la survie de HIF-1. Les résultats obtenus démontrent quoique la vitamine C, un anti-oxydant bien connu, contribue à neutraliser les radicaux libres, ce qui diminué la concentration de HIF-1 dans les tumeurs. Les cellules cancéreuses n'ont par conséquent plus d'énergie pour survivre et cela diminue énormément la progression de la tumeur.
Références
Fondation québécoise du cancer, La vitamine C bloquerait certains cancers, 10 septembre 2007 [1]
GOTHIÉ, Emmanuel. Jacques POUYSSÉGUR. “HIF-1 : régulateur central de l'hypoxie”. Médecine/Sciences, volume 18, numéro 1, 18 janvier 2002. [2]
LAUZIER, Marie-Claude, et al. “Activation de HIF1 dans le cancer : implications et conséquences”. Bull Cancer, volume 93, numéro 4, avril 2006.
MAXWELL, P. H. “Le facteur HIF-1 induit par l'hypoxie et la sensibilité à l'oxygène”. Flammarion Médecine-Sciences, Actualités néphrologiques 2006 [3], 24 novembre 2007
NCBI. OMIM, Hypoxia-inducible factor 1, alpha subunit; HIF1A, [4], 24 novembre 2007
WENGER, Roland H. “Cellular adaptation to hypoxia : O2-sensing protein hydroxylases, hypoxia-inducible transcription factors, and O2-regulated gene expression“. The FASEB Journal. 2002. [5]
Recherche sur Google Images : |
|
"Facteur induit par l'hypoxie -" L'image ci-contre est extraite du site fr.wikipedia.org Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (180 x 187 - 10 ko - jpg)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 05/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité